15 квітня 2022 рокуТема: Теплові двигуни. Оборотні та необоротні процеси.
Другий закон термодинаміки.
Виконати завдання:- переглянути відео
- повторити §29 ст.181-186
- дати письмово відповіді на питання 4, 5в кінці параграфа
Використані джерела: https://www.youtube.com/watch?v=rfOI3PwO19414 квітня 2022 рокуТема: Адіабатний процес.Виконати завдання:- переглянути відео
- опрацювати §29
ст.181-186
- дати письмово відповіді на питання 1,2 в кінці параграфа
Використані джерела: https://www.youtube.com/watch?v=BINQBDb4QHc12 квітня 2022 рокуТема: Застосування першого закону термодинаміки до
ізопроцесів в ідеальному газі.
Виконати завдання:- переглянути відео
- записати до зошита формулу і означення першого закону термадинаміки в ізопроцесах
- опрацювати §28
ст.176-181
- виконати вправу 27(8)
Використані джерела: https://www.youtube.com/watch?v=BJVedLtC5kA08 квітня 2022 рокуТема: Кількість теплоти та робота в термодинаміці.
Виконати завдання:- переглянути відео
- записати до зошита формулу і розшифрувати внутрішньої енергії ідеального одноатомного газу
- опрацювати §28
ст.176-181
- виконати вправу 27(4)
Використані джерела:
07 квітня 2022 рокуТема: Внутрішня енергія. Перший закон термодинаміки.
Виконати завдання:- переглянути відео
- опрацювати §27
ст.168-176
- виконати вправу 26(7)
Використані джерела:05 квітня 2022 рокуТема: Основні поняття термодинаміки.
Основні поняття термодинаміки: система, фаза, компонент, процес, параметр, функція стану, енергія, робота, теплота.- переглянути відео
- повторити §29 ст.181-186
- дати письмово відповіді на питання 4, 5в кінці параграфа
- переглянути відео
- опрацювати §29 ст.181-186
- дати письмово відповіді на питання 1,2 в кінці параграфа
- переглянути відео
- записати до зошита формулу і означення першого закону термадинаміки в ізопроцесах
- опрацювати §28 ст.176-181
- виконати вправу 27(8)
- переглянути відео
- записати до зошита формулу і розшифрувати внутрішньої енергії ідеального одноатомного газу
- опрацювати §28 ст.176-181
- виконати вправу 27(4)
- переглянути відео
- опрацювати §27 ст.168-176
- виконати вправу 26(7)
Термодинаміка це наука, що вивчає взаємні перетворення теплоти і роботи в теплових двигунах.
Термодинамічна система — це тіло або сукупність тіл, відділених від навколишнього світу уявною або дійсно існуючою оболонкою. Тіла, які перебувають за межами термодинамічної системи, утворюють навколишнє середовище.
В залежності від характеру взаємодії з навколишнім середовищем розрізняють системи відкриті, закриті та ізольовані. Відкрита система обмінюється з навколишнім середовищем речовиною та енергією. Закрита може обмінюватися енергією, але не обмінюється речовиною. Ізольована система позбавлена можливості обміну з навколишнім середовищем як речовиною, так і енергією.
Сукупність частин термодинамічної системи з однаковим складом і властивостями називають фазою. Гомогенна система складається з однієї фази (газ, розчин), гетерогенна система - з кількох фаз, відділених одна від одної поверхнями поділу (пара—розчин, вода—масло).
Фізичні характеристики термодинамічної системи (маса, об'єм, температура, тиск, склад, енергія, теплоємність та ін.) називаються термодинамічними властивостями. Вони поділяються на екстенсивні та інтенсивні. До екстенсивних властивостей відносяться: маса, об'єм, енергія, теплоємність та ін. Вони використовуються як кількісні характеристики термодинамічної системи, залежать від маси і характеризуються адитивністю, тобто екстенсивна властивість системи дорівнює сумі відповідних властивостей її складових частин. До інтенсивних властивостей належать: температура, тиск, склад, густина та ін. Вони дають якісну характеристику термодинамічної системи, не залежать від маси і неадитивні.
Стан термодинамічної системи характеризують термодинамічними параметрами (температура, тиск, об'єм, внутрішня енергія, ентропія та ін.). Параметри, які підлягають безпосередньому вимірюванню (інтенсивні властивості), називаються основними параметрами стану. Інші параметри стану системи є функціями від основних параметрів (внутрішня енергія, ентальпія, ентропія та ін.). Ці термодинамічні функції називають функціями стану, тому що їх зміна при переході системи з одного стану в інший не залежить від шляху переходу, а визначається тільки початковим та кінцевим станами системи.
Зміна одного чи декількох параметрів стану системи називається термодинамічним процесом. В оборотному процесі система повертається в початковий стан без будь-яких енергетичних змін в навколишньому середовищі. В протилежному випадку процес є необоротним.
В рівноважному процесі система проходить через безперервний ряд рівноважних станів. Під рівноважним розуміють такий стан, який не змінюється в часі при незмінності зовнішніх факторів.
Процес може бути самодовільним або несамодовільним. До самодовільних відносяться процеси, що проходять без витрати енергії ззовні.
В залежності від того, який з параметрів стану в термодинамічному процесі залишається незмінним, розрізняють ізотермічний (Т = const), ізобаричний (р = const), ізохоричний (V = const) процеси. Адіабатичним називають процес, в якому Q = 0, тобто система ізольована в тепловому відношенні.
Особливе місце в термодинаміці займають так звані кругові процеси — термодинамічні цикли. Круговим називається процес, в результаті якого система після ряду змін повертається в початковий стан.
Теплота (Q) і робота (W) — це форми передачі енергії від системи до навколишнього середовища і навпаки.
Теплотою називають форму передачі енергії внаслідок хаотичного руху молекул. При виконанні роботи енергія передається шляхом упорядкованого руху молекул під дією певної сили. Направлений рух молекул може бути перетворений в хаотичний. Тоді робота переходить в теплоту.
Спільна властивість теплоти і роботи полягає в тому, що вони характеризують не стан системи, а процес, який в ній відбувається. Не можна казати про запас теплоти або роботи в системі, а тільки про теплоту і роботу певного процесу. Теплота і робота залежать від шляху процесу, отже, вони є функціями процесу, а не стану. Теплоту і роботу виражають в джоулях (Дж).
В термодинаміці додатною величиною вважають теплоту, яку поглинає система, а від’ємною — теплоту, яку вона виділяє. Робота вважається додатною величиною, якщо вона чиниться системою, і від’ємною — якщо вона чиниться над системою.
Енергія - міра руху (чим інтенсивніше рух, тим більше енергія) при його перетворенні з одного виду в інший. Внутрішня енергія - енергія руху молекул, атомів, електронів і ядерна (атомна) енергія.
- Прочитати викладений матеріал.
- Виписати основні означення до зошита
- Прочитати §27 ст.168-176
- Виконати вправу 26(5)
01 квітня 2022 рокуТема: Контрольна
робота № 5 з теми «Молекулярна фізика»31 березня 2022 рокуТема: Рідкі кристали та їх властивості. Виконати завдання:- переглянути презентацію
- виконати тести 1-5,
- розв'язати задачу 8 ст. 227
Використані джерела:
29 березня 2022 рокуТема: Механічні властивості твердих тіл, їх теплове
розширення.
Виконати завдання:- переглянути відео
- опрацювати §38
ст.223-226
- виконати вправу 33(2)
Використані джерела:25 березня 2022 рокуТема: Механічна напруга твердих тіл. Закон Гука, модуль
Юнга.
Виконати завдання:- Записати і розшифрувати формулу закону Гука
- Виконати вправу 32(5)
Використані джерела:https://svitppt.com.ua/fizika/kristalichni-ta-amorfni-tila-zakon-guka.htmlhttps://pt.slideshare.net/Melada2011/ss-33881079
24 березня 2022 рокуТема: Види деформації твердих тіл.
Виконати завдання:- переглянути відео
- записати до зошита означення та види деформації
- виконати вправу 32(2)
Використані джерела:- https://www.youtube.com/watch?v=t4gppyNJBAA
- https://ppt-online.org/539398
- https://naurok.com.ua/vidi-deformaci-sila-pruzhnosti-zakon-guka-156194.html
22 березня 2022 рокуТема: Тверді тіла (кристалічні та аморфні). Монокристали,
полікристали. Анізотропія кристалів.
Виконати завдання:- переглянути відео
- Опрацювати §36
ст.214-218
- дати відповідь на питання 1-2 в кінці параграфа
Використані джерела:https://www.youtube.com/watch?v=93Dh-27t4G8
17 березня 2022 рокуТема: Будова рідини. Поверхневий натяг рідини.
Змочування. Капілярні явища.
Виконати завдання:- переглянути відео
- записати означення і формули з картинок
- опрацювати §34-35
ст.204-213
- виконати вправу 30(3)
- відповіді надсилати у Viber в особисті повідомлення
Використані джерела:https://www.youtube.com/watch?v=E-MIh5Mhi6Ehttps://naurok.com.ua/prezentaciya-vlastivosti-ridini-poverhneviy-natyag-zmochuvannya-kapilyarni-yavischa-203704.html
15 березня 2022 року Лабораторна
робота № 7. Вимірювання відносної вологості повітря
Тема: Визначення вологості повітря за допомогою психрометра.
Мета: ознайомитись з методами вимірювання вологості повітря і з їх допомогою визначити відносну вологість повітря.
Прилади і матеріали: волосяний і конденсаційний гігрометри, психрометр, психрометрична таблиця.
Обладнання: Психрометр, склянка з водою, психрометрична таблиця, таблиця густини насиченої водяної пари при різних температурах.
Теорія методу:Психрометр являє собою два термометри, один з яких обгорнутий змоченою у воді тканиною. Випаровування води з тканини залежить від вологості повітря, тому чим менша відносна вологість, тим менша температура вологого термометра. Визначається вологість за допомогою психрометричної таблиці.Температура повітря t – покази сухого термометра. Густину насиченої пари визначають з таблиці густини насиченої водяної пари. Абсолютна вологість визначається з формули Хід роботи:Змочити тканину вологого термометра і визначити місце, вказане в таблиці варіантів.Записати покази сухого та вологого термометра.Визначити різницю показів сухого і вологого термометрів.Скориставшись психрометричною таблицею визначити відносну вологість повітря b.З таблиці густини насиченої пари визначити густину насиченої пари при даній температурі.З таблиці густини насиченої пари визначити точку роси tp.Результати вимірювань та обчислень занести в таблицю.9. Опишіть будову та принцип дії приладів А) психрометр Будова: Принцип дії:
Б) волосяний гігрометр Будова: Принцип дії:
Волосяний гігрометр
 Прилади для прямого вимірювання вологості повітря називають гігрометрами. Існує декілька видів гігрометрів: волосяний і психрометричний. Принцип дії волосяного гігрометра базується на властивості знежиреної волосини збільшувати свою довжину зі збільшенням вологості повітря. Узимку волосяний гігрометр є основним приладом для вимірювання вологості повітря поза приміщенням.
Прилади для прямого вимірювання вологості повітря називають гігрометрами. Існує декілька видів гігрометрів: волосяний і психрометричний. Принцип дії волосяного гігрометра базується на властивості знежиреної волосини збільшувати свою довжину зі збільшенням вологості повітря. Узимку волосяний гігрометр є основним приладом для вимірювання вологості повітря поза приміщенням.
Найчастіше використовують гігрометр психрометричний – психрометр.
Психрометр
Психрометр складається з двох термометрів – сухого, який вимірює температуру довкілля, і вологого – його колба обгорнута тканиною, кінчик якої опущений у посудину з водою (рис.8.2). Вода з тканини випаровується, і вологий термометр показує нижчу температуру, ніж сухий. Чим нижча відносна вологість повітря, тим швидше випаровується рідина і тим більша різниця показів сухого та вологого термометрів. Відносну вологість визначають за допомогою психрометричної таблиці.
10.Зробити висновок.
Контрольні запитання
- Чому покази вологого термометра психрометра менші за покази сухого термометра?
- При яких умовах різниця показів термометрів найбільша?
- Температура в приміщенні знижується, а абсолютна вологість залишається сталою. Як зміниться відносна вологість?
- Сухий і вологий термометр показують однакову температуру. Яка відносна вологість повітря?
Виконати завдання:- Переглянути відео
- Написати лабораторну роботу на окремому аркуші паперу, як ми записуємо на уроках фізики.
- Відповісти на контрольні запитання після лобораторної роботи.
Використані джерела:- https://www.youtube.com/watch?v=ghXYywer-kc
- https://vseosvita.ua/library/laboratorna-robota-no7-tema-viznacenna-vologosti-povitra-za-dopomogou-psihrometra-218005.html
24 лютого та 25 лютого 2022 рокуТема: Властивості насиченої та ненасиченої пари. Вологість повітря, її вимірювання. Точка роси. Рівновага фаз та фазові переходи.
- переглянути презентацію
- виконати тести 1-5,
- розв'язати задачу 8 ст. 227
- переглянути відео
- опрацювати §38 ст.223-226
- виконати вправу 33(2)
- Записати і розшифрувати формулу закону Гука
- Виконати вправу 32(5)
- переглянути відео
- записати до зошита означення та види деформації
- виконати вправу 32(2)
- https://www.youtube.com/watch?v=t4gppyNJBAA
- https://ppt-online.org/539398
- https://naurok.com.ua/vidi-deformaci-sila-pruzhnosti-zakon-guka-156194.html
- переглянути відео
- Опрацювати §36 ст.214-218
- дати відповідь на питання 1-2 в кінці параграфа
- переглянути відео
- записати означення і формули з картинок
- опрацювати §34-35 ст.204-213
- виконати вправу 30(3)
- відповіді надсилати у Viber в особисті повідомлення
Мета: ознайомитись з методами вимірювання вологості повітря і з їх допомогою визначити відносну вологість повітря.
Прилади і матеріали: волосяний і конденсаційний гігрометри, психрометр, психрометрична таблиця.
Обладнання: Психрометр, склянка з водою, психрометрична таблиця, таблиця густини насиченої водяної пари при різних температурах.
Б) волосяний гігрометр Будова: Принцип дії:
Волосяний гігрометр
 Прилади для прямого вимірювання вологості повітря називають гігрометрами. Існує декілька видів гігрометрів: волосяний і психрометричний. Принцип дії волосяного гігрометра базується на властивості знежиреної волосини збільшувати свою довжину зі збільшенням вологості повітря. Узимку волосяний гігрометр є основним приладом для вимірювання вологості повітря поза приміщенням.
Прилади для прямого вимірювання вологості повітря називають гігрометрами. Існує декілька видів гігрометрів: волосяний і психрометричний. Принцип дії волосяного гігрометра базується на властивості знежиреної волосини збільшувати свою довжину зі збільшенням вологості повітря. Узимку волосяний гігрометр є основним приладом для вимірювання вологості повітря поза приміщенням.Найчастіше використовують гігрометр психрометричний – психрометр.
Психрометр
Психрометр складається з двох термометрів – сухого, який вимірює температуру довкілля, і вологого – його колба обгорнута тканиною, кінчик якої опущений у посудину з водою (рис.8.2). Вода з тканини випаровується, і вологий термометр показує нижчу температуру, ніж сухий. Чим нижча відносна вологість повітря, тим швидше випаровується рідина і тим більша різниця показів сухого та вологого термометрів. Відносну вологість визначають за допомогою психрометричної таблиці.
10.Зробити висновок.
Контрольні запитання
- Чому покази вологого термометра психрометра менші за покази сухого термометра?
- При яких умовах різниця показів термометрів найбільша?
- Температура в приміщенні знижується, а абсолютна вологість залишається сталою. Як зміниться відносна вологість?
- Сухий і вологий термометр показують однакову температуру. Яка відносна вологість повітря?
- Переглянути відео
- Написати лабораторну роботу на окремому аркуші паперу, як ми записуємо на уроках фізики.
- Відповісти на контрольні запитання після лобораторної роботи.
- https://www.youtube.com/watch?v=ghXYywer-kc
- https://vseosvita.ua/library/laboratorna-robota-no7-tema-viznacenna-vologosti-povitra-za-dopomogou-psihrometra-218005.html
План:
- Вологість.
- Точка роси.
- Способи визначення вологості повітря.
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Вологість
У повітрі завжди міститься якась кількість водяної пари. На відміну від водяної пари, повітря є необхідною умовою існування життя на Землі. Як же оцінити ступінь вологості повітря? Така оцінка особливо важлива, наприклад, для складання прогнозу погоди.
Щоб здійснити аналіз ступеня вологості повітря, важливо знати, наскільки водяна пара, що знаходиться в ньому, відрізняється, від стану насичення. Наприклад, тиск водяної пари (кімнатної температури) складає близько 2 % від звичайного атмосферного тиску.
Тиск ненасиченої пари менший за тиск насиченої. Тому ступінь «насиченості» водяної пари можна тлумачити як відношення тиску водяної пари до тиску насиченої пари за тієї ж температури. Ця величина, виражена у відсотках, називається відносною вологістю і позначається ф.
Отже, відносною вологістю повітря φ називають відношення тиску водяної пари за даної температури р до тиску насиченої пари pн з тією ж температурою.

Зазвичай комфортні умови для людини відповідають вологості близько 50 — 60 %.
2. Точка роси
Якщо кількість водяної пари в повітрі не змінюється, то зі зниженням температури відносна вологість зростає, у цей момент, водяна пара ближча до насичення. Зниженням температури відносну вологість можна довести до 100 %, не змінюючи кількості пари, яка міститься в ній. При подальшому зниженні температури вологість вже не збільшується, а частина водяної пари конденсується. З’являється туман, випадає роса. Температуру, за якої водяна пара стає насиченою, називають точкою роси. Тепер учням стане зрозуміло, чому тумани частіше бувають уранці, і чому роса випадає вранці, коли повітря вночі охолоняє.
Температуру, за якої водяна пара стає насиченою, називають точкою роси.

3. Способи визначення вологості повітря
Вологість вимірюють за допомогою спеціальних приладів, один з яких називається психрометром. Психрометр складається з двох термометрів: сухого і вологого. Через випаровування води вологий термометр звичайно показує нижчу температуру, ніж сухий: чим нижча відносна вологість, тим більша різниця показників. З їх урахуванням, за допомогою заздалегідь складеної таблиці, визначають відносну вологість повітря.
Сучасні психрометри можна розділити натри категорії: станційні, аспіраційні та дистанційні. У станційних психрометрах термометри закріплені на спеціальному штативі в метеорологічній будці. Основний недолік станційних психрометрів — залежність показань зволоженого термометра від швидкості повітряного потоку в будці.
У аспіраційному психрометрі термометри розташовані в спеціальній оправі, яка захищає їх від пошкоджень і теплового впливу прямих сонячних променів, де обдуваються за допомогою аспіратора (вентилятора) потоком досліджуваного повітря з постійною швидкістю близько 2 м/с. Якщо температура повітря позитивна, аспіраційний психрометр — найбільш надійний прилад для вимірювання температури та вологості повітря. У дистанційних психрометрах використовуються термометри опору, терморезистори, термопари.
Ø Гігрометр — вимірювальний прилад для визначення вологості повітря. Існує кілька типів гігрометрів, дія яких заснована на різних принципах: ваговий, волосяний, плівковий і т.д.
Дія волосяного гігрометра заснована на властивості знежиреного волосся — змінювати свою довжину при зміні вологості повітря, що дозволяє вимірювати відносну вологість від 30 до 100 %. Волосина натягнута на металеву рамку. Зміна довжини волосся передається стрілці, що переміщується уздовж пікали.
Плівковий гігрометр має чутливий елемент з органічної плівки, яка розтягується при підвищенні вологості й стискається під час зниження. Зміна положення центру плівкової мембрани передається стрілці. Волосяний і плівковий гігрометр у зимовий час є основним приладом для вимірювання вологості повітря. Показники волосяного й плівкового гігрометрів періодично порівнюються з показниками більш точного приладу — психрометра.

Вткористані джерела:
- https://subject.com.ua/lesson/physics/10klas_2/83.html
- https://subject.com.ua/lesson/physics/10klas_4/42.html
- https://uabooks.top/501-vlastivost-nasichenoyi-n-nenasichenoyi-pari-volotst-povtrya.html
Тема: "Швидкості руху молекул газу та їхнє вимірювання. Дослід Штерна."План:· Швидкість руху молекул газу
· Дослід Штерна
Швидкість руху молекул газу. Прирівнюючи формули для середньої кінетичної енергії поступального руху молекул газу можна отримати вираз для середньої квадратичної швидкості руху молекул.
З формул  і
і  отримуємо
отримуємо  .
.
Обчисливши за цією формулу середню квадратичну швидкість, наприклад, молекул азоту при t = 0 °С, отримуємо значення 500 м/с. Молекули водню при t = 0 °С мають швидкість 1800 м/с.
Коли вперше дістали ці числа (друга половина XIX ст.), то це приголомшило багатьох фізиків, і вони висловили сумніви щодо правильності молекулярно-кінетичної теорії. Адже відомо, що пахощі поширюються досить повільно: потрібні десятки секунд, щоб пахощі парфумів, розлитих в одному кутку кімнати, досяг іншого кутка. Наразі ви можете це легко пояснити великою кількістю зіткнень між молекулами.
Дослід Штерна. Вперше швидкість теплового руху атомів експериментально визначив у 1920 році німецький вчений-фізик О. Штерн (1888 - 1969). Він користувався приладом, схему якого зображено на мал. 24, а.
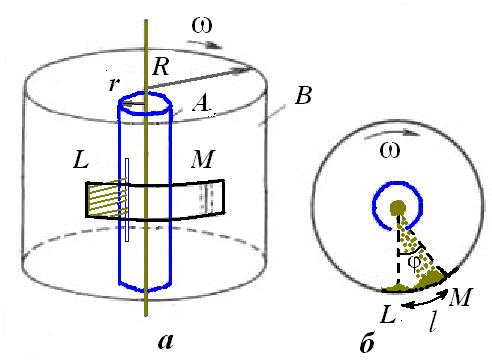
мал.1 Схема установки для вимірювання швидкості руху молекул; б – зміщення пучка атомів при обертанні циліндрів
Уздовж осі двох жорстко з’єднаних циліндрів (А і В) різних діаметрів зі спільною віссю розміщувався платиновий дріт, покритий шаром срібла. Внутрішній циліндр (А) мав щілину. Дріт нагрівався під час пропускання електричного струму через нього і при t = 1300 °С срібло з його поверхні випаровувалось. У такий спосіб у камері циліндрів, повітря з якої заздалегідь відкачувалося до тиску 1,3·10-4 Па, утворювався газ із атомів Аргентуму. У результаті на зовнішньому циліндрі (В) навпроти щілини утворювався срібний наліт. Його положення на мал. 24, а, б визначається областю L.
Потім циліндри обертали із частотою ω. За час t, потрібний атомам для проходження відстані, що дорівнює різниці радіусів циліндрів (R – r), циліндри поверталися на деякий кут. Через це атоми, що рухалися зі сталою швидкістю, потрапляли на внутрішню поверхню великого циліндра (В) не проти щілини, а на певній відстані, у область М (мал. 1).
Зміщення нальоту пояснюється тим, що за час t, поки атоми срібла із швидкістю  пролітають відстань (R – r), зовнішній циліндр встигає повернутись на кут
пролітають відстань (R – r), зовнішній циліндр встигає повернутись на кут  . Відповідно, кожна точка поверхні зовнішнього циліндра зміщується на відстань
. Відповідно, кожна точка поверхні зовнішнього циліндра зміщується на відстань  , де
, де  - радіус зовнішнього циліндра,
- радіус зовнішнього циліндра,  - лінійна швидкість руху точок на його поверхні. Це призводить до зміщення точок осідання атомів срібла.
- лінійна швидкість руху точок на його поверхні. Це призводить до зміщення точок осідання атомів срібла.
Оскільки наліт в області М розмивається, то це підтверджує те, що не всі атоми мають однакову швидкість. Тому для подальших розрахунків використовують середнє значення швидкості 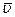 .
.
Таким чином час t, поки атоми срібла із швидкістю 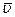 пролітають відстань (R – r), можна визначити так:
пролітають відстань (R – r), можна визначити так:  .
.
Звідки  .
.
Знаючи радіуси циліндрів R та r, кутову швидкість їх обертання ω та вимірявши відстань (  ) між областями L і М (між точками найбільшого скупчення атомів) можна визначити швидкість руху молекул.
) між областями L і М (між точками найбільшого скупчення атомів) можна визначити швидкість руху молекул.
У досліді О.Штерна було встановлено, що середня швидкість руху атомів срібла дорівнює 650 м/с.
Цей фундаментальний дослід є експериментальним доказом існування атомів речовини і правильності молекулярно-кінетичної теорії в цілому.
Дайте відповідь на запитання
1. Як можна визначити середню квадратичну швидкість руху молекул газу?
2. Побудуйте схему досліду Штерна і поясніть його сутність.
3. Запишіть формулу, за якою визначають середню швидкість руху атомів речовини в досліді Штерна.
· Швидкість руху молекул газу
· Дослід Штерна
Швидкість руху молекул газу. Прирівнюючи формули для середньої кінетичної енергії поступального руху молекул газу можна отримати вираз для середньої квадратичної швидкості руху молекул.
З формул  і
і  отримуємо
отримуємо  .
.
Обчисливши за цією формулу середню квадратичну швидкість, наприклад, молекул азоту при t = 0 °С, отримуємо значення 500 м/с. Молекули водню при t = 0 °С мають швидкість 1800 м/с.
Коли вперше дістали ці числа (друга половина XIX ст.), то це приголомшило багатьох фізиків, і вони висловили сумніви щодо правильності молекулярно-кінетичної теорії. Адже відомо, що пахощі поширюються досить повільно: потрібні десятки секунд, щоб пахощі парфумів, розлитих в одному кутку кімнати, досяг іншого кутка. Наразі ви можете це легко пояснити великою кількістю зіткнень між молекулами.
Дослід Штерна. Вперше швидкість теплового руху атомів експериментально визначив у 1920 році німецький вчений-фізик О. Штерн (1888 - 1969). Він користувався приладом, схему якого зображено на мал. 24, а.

мал.1 Схема установки для вимірювання швидкості руху молекул; б – зміщення пучка атомів при обертанні циліндрів
Уздовж осі двох жорстко з’єднаних циліндрів (А і В) різних діаметрів зі спільною віссю розміщувався платиновий дріт, покритий шаром срібла. Внутрішній циліндр (А) мав щілину. Дріт нагрівався під час пропускання електричного струму через нього і при t = 1300 °С срібло з його поверхні випаровувалось. У такий спосіб у камері циліндрів, повітря з якої заздалегідь відкачувалося до тиску 1,3·10-4 Па, утворювався газ із атомів Аргентуму. У результаті на зовнішньому циліндрі (В) навпроти щілини утворювався срібний наліт. Його положення на мал. 24, а, б визначається областю L.
Потім циліндри обертали із частотою ω. За час t, потрібний атомам для проходження відстані, що дорівнює різниці радіусів циліндрів (R – r), циліндри поверталися на деякий кут. Через це атоми, що рухалися зі сталою швидкістю, потрапляли на внутрішню поверхню великого циліндра (В) не проти щілини, а на певній відстані, у область М (мал. 1).
Зміщення нальоту пояснюється тим, що за час t, поки атоми срібла із швидкістю  пролітають відстань (R – r), зовнішній циліндр встигає повернутись на кут
пролітають відстань (R – r), зовнішній циліндр встигає повернутись на кут  . Відповідно, кожна точка поверхні зовнішнього циліндра зміщується на відстань
. Відповідно, кожна точка поверхні зовнішнього циліндра зміщується на відстань  , де
, де  - радіус зовнішнього циліндра,
- радіус зовнішнього циліндра,  - лінійна швидкість руху точок на його поверхні. Це призводить до зміщення точок осідання атомів срібла.
- лінійна швидкість руху точок на його поверхні. Це призводить до зміщення точок осідання атомів срібла.
Оскільки наліт в області М розмивається, то це підтверджує те, що не всі атоми мають однакову швидкість. Тому для подальших розрахунків використовують середнє значення швидкості 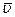 .
.
Таким чином час t, поки атоми срібла із швидкістю 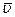 пролітають відстань (R – r), можна визначити так:
пролітають відстань (R – r), можна визначити так:  .
.
Звідки  .
.
Знаючи радіуси циліндрів R та r, кутову швидкість їх обертання ω та вимірявши відстань (  ) між областями L і М (між точками найбільшого скупчення атомів) можна визначити швидкість руху молекул.
) між областями L і М (між точками найбільшого скупчення атомів) можна визначити швидкість руху молекул.
У досліді О.Штерна було встановлено, що середня швидкість руху атомів срібла дорівнює 650 м/с.
Цей фундаментальний дослід є експериментальним доказом існування атомів речовини і правильності молекулярно-кінетичної теорії в цілому.
Дайте відповідь на запитання
1. Як можна визначити середню квадратичну швидкість руху молекул газу?
2. Побудуйте схему досліду Штерна і поясніть його сутність.
3. Запишіть формулу, за якою визначають середню швидкість руху атомів речовини в досліді Штерна.




















Немає коментарів:
Дописати коментар